キレート滴定法を実際試料の分析に応用する場合,そ の成否を左右する最も大きな要素は,滴 定の選択性をい かにして高めるかにあるといっても過言ではないな ぜ なら,edtaを 用いるキレート滴定法は,京都大学 全学共通教育 基礎化学実験ホームページ:http//wwwchemzenkyohkyotouacjp/化学実験操作法:操作法 2 4 キレート キレー ト滴定法は, 金属キレー ト錯体の生成反応を利用して,金属イオンを定量する方法である。 たとえば,水道水など飲料水中に含まれるマグネシウムおよびカルシウムイオン濃度, すなわち,水の硬度はEDTAを用いるキレー ト滴定によって簡単に測定できる。EDTA の他にも多数のキレート滴定剤および指示薬が開発され,大部分の金属イオンが滴定法によって定量できるようになった。

17 号 可搬型滴定装置 Astamuse
キレート滴定 計算 亜鉛
キレート滴定 計算 亜鉛-キレート滴定 1.目的 キレート滴定法を用いて、未知試料中に含まれる金属イオン(Ca 2+、Mg 2+)の濃度 を調べ、さらに水の硬度についても計算して求める。また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。Jul 07, · 投稿日:7月 7, こんにちは、trans (トランス)です。 今回は、キレート滴定法を用いて、水道水と飲料水の硬度を算出する実験について紹介します。 まず、硬度の章では、硬度とは何か,飲料水の硬水と軟水の違いなどを紹介します。 次に、キレート滴定の章では、キレート滴定の基本的な原理,金属指示薬とpHの関係,硬度を求める方法などについて説明します



Recent Media ファーマ通信予備校 徳島校
キレート滴定やイオン交 換,溶媒抽出の原理が 説明でき,それらを利用 した分析法に関する計算 を4/5以上できる。 キレート滴定やイオン交 換,溶媒抽出の原理が 説明でき,それらを利用 した分析法に関する計算 を3/4程度できる。 キレート滴定やイオン交用いて、赤色から黄色に変化するまで滴定する。(キシレノールオレンジ指示薬でも、 色の変化は同じ) D Cu 2 濃度の計算 j) Cu 2 の滴定に必要なエチレンジアミン四酢酸二ナトリウム塩の量は、滴定 B と滴定 C の滴定量の差として計算される。水の硬度計算 こんなサイトがあるとは知りませんでした。 ありがとうございます。 馬鹿なことをお伺いしますが、ペットボトルには100mL中の成分表示がされています。 これをそのまま入力すればよいのですよね。 入力欄は1L = 1000mL辺りの含有量になり
Jun 05, 21 · キレート滴定で脱イオン水を使う理由を教えてください。 カチオンがあると、滴定に影響するから。 解決済み 質問日時: 21/5/10 1503 回答数: 1 閲覧数: 3 教養と学問、サイエンス > サイエンス > 化学 化学のキレート滴定についての計算です。キレート滴定の計算方法 1 試薬の体積と初濃度 塩化アンモニウムNH 4 Cl-アンモニア水NH 3 系のpH緩衝液により,常にpH=10一定であると仮定する.計算を簡単化するために,カルシウムイオンCa 2 やマグネシウムイオンMg 2 と指示薬のエリオクロムブラックT(EBT)の錯体形成反応(化学平衡)を無視する.EDTA・2Naの必要量計算 1) 乾燥した空の秤量瓶の質量を分析天秤で測定する。 2) 秤量瓶に上皿天秤(電子天秤)を使って、EDTA・2Naを約0.9g採取する。 3) 分析天秤で、EDTA・2Naを入れた秤量瓶の質量を精秤する。 4)
⑥ビュレットの0010mol/L EDTA標準溶洷で滴定を行う。溶洷の色が赤紫色から青色に なったところが終点である。 ⑦ ②~⑥を3回繰り返し、滴定値の平均を求める。 4.Ca硬度の測定とMg硬度の計算4.001M EDTA標準溶液で滴定し、赤色が完全に青色に変わる点を終点とする。 5.滴定結果より、試料溶液250ml中に存在するCaの重量を計算する。 1)MgEDTA溶液の調整 Mg(NO3)2・6H2Oのごく少量をビーカーにとり、水に溶解して約 mlとし、pHモル濃度の計算方法 陽イオンの価数に関係なく1:1で反応します.滴定に使用した既知濃度のEDTAの体積とモル濃度をV(m し )とC(mol/ し )とします.最初に分取した未知濃度の試料の体積とモル濃度をV'(m し )とC'(mol/ し )すると C'V'=CV ∴ C'=CV/V' 水の硬度 (ppm) 水1000 m し (=1000 g)中に存在するCa 2 とMg 2 のモル数の和が,それと同じモル数の炭酸カルシウムCaCO




キレート滴定 Kyo Aroma Breath 京都 京北での精油採取から 暮らしの香りへ



分析化学テスト対策 Noegoism
Mar 14, 21 · キレート滴定 計算 亜鉛 また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。 I キレート滴定による亜鉛イオン濃度の決定 1 キレート滴定におけるチオ硫酸ナトリウムの役割を説明せよ。レート滴定法の原理,そこで用い られる応用的な手法(逆滴定,置換滴定,マ スキングなど)につい て概説するとともに,これを用 い たい くつ かの金属イオンの定量法を紹介する。 1 は じめ に キレート滴定は,G, Schwarzenbach(シュ ヴァ ルツ ェキレート滴定による銅と亜鉛の定量 調整した真鍮の試料溶液5cm3を001mol/L EDTA標準溶液で3回滴定を行った。 3回の滴定の平均は95mlであった。 Cu2+とZn2+のいずれもが、それぞれ1:1でEDTAとキレート化合物を作る1)ので、




1997 号 金属イオンのための酵素増幅競合アッセイ及びサンドイッチキレート化アッセイ Astamuse




1999 1017号 滴定制御方法 Astamuse
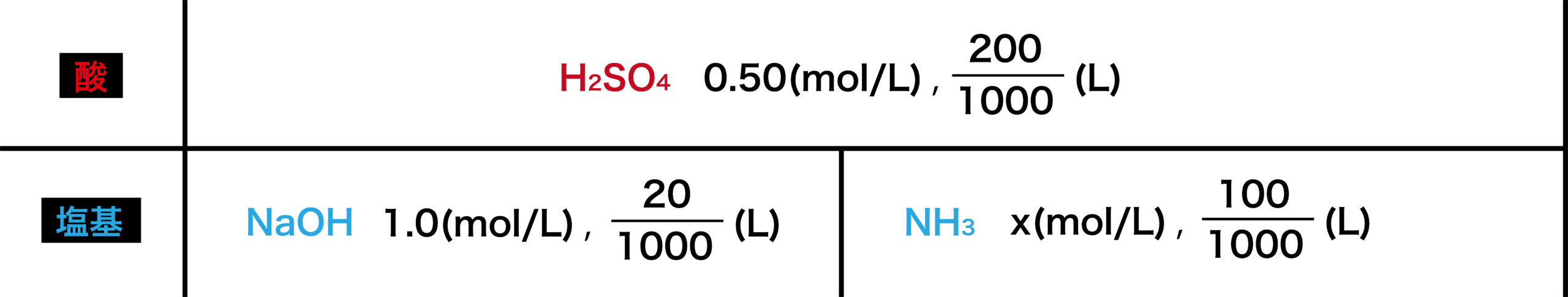
例えば, mol/LのEDTA水溶液を用いて,検水0 mLを滴定したところ,130 mL加えたところで反応が完了したならば,硬度 = 100××130×1000÷0 = 650 ということになる。 5 実験キレート滴定 多座配位子EDTA(標準液)が 金属イオン(Zn 2, Mg 2, Ca , Al3, Cu 等)と 水溶液中で安定な可溶性のキレート化合物を生成する ことを利用した滴定法 →容量分析による金属イオンの定量法 *滴定終点判定法は次週に解説する 9 キレート滴定のMar 30, 18 · 以下に示す式により換算できます。 総硬度=Ca(mg/L)×25+Mg(mg/L)×41 総硬度の高い水を硬水、総硬度の低い水を軟水と言います。 硬水を飲むと下痢などの胃腸障害を起こすことがあるなど、総硬度の違いが生体に影響を及ぼすことがあります。 日本の水道水は軟水が多く、海外の水道水は硬水が多いため、海外旅行者が水道水を飲むことによって普段より高度




Images Of キレート滴定 Japaneseclass Jp



逆滴定 例題 計算問題の解き方 原理など 化学のグルメ
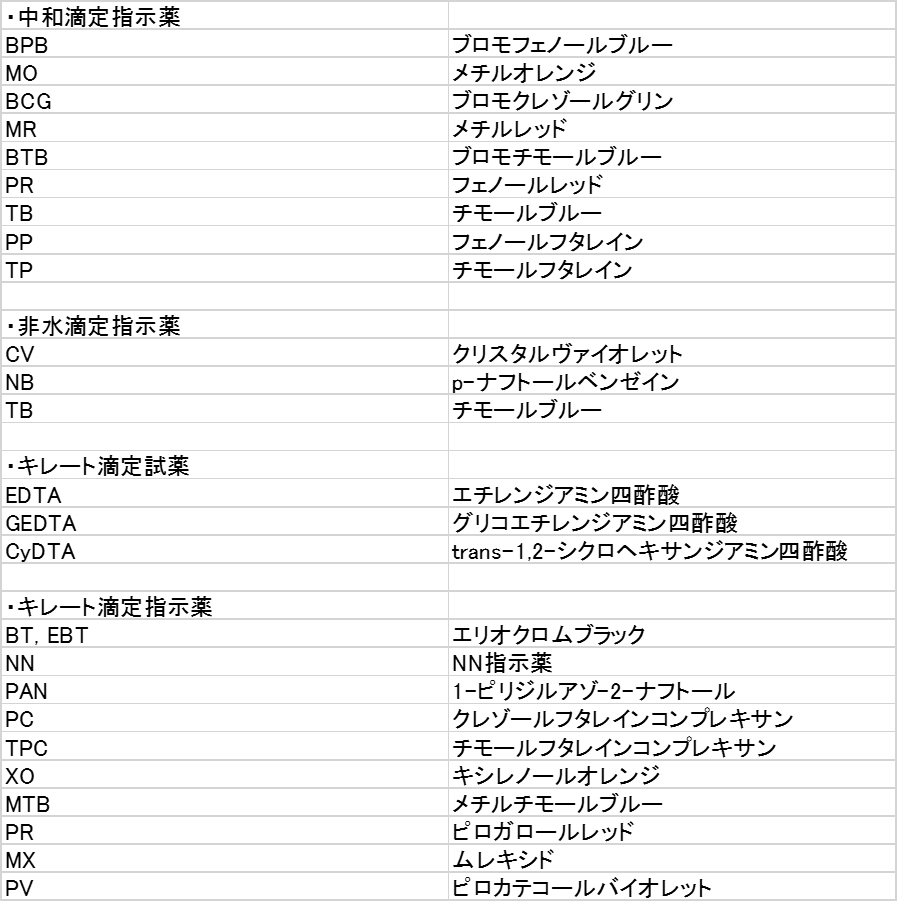
硬 度 = EDTAの滴定量 × 1000/試料100ml (硬度は1リットル中の量として表すため1000をかける) 解説 この実験では金属イオンにEDTAを加え、金属キレート化合物を生成させ、それをEBTのような金属指示薬で滴定しています。(5) 滴定・終点操作 (ア) 手際よく滴定操作ができている。 (イ) 終点の判断が適切である。 3 完成度・結果について 1 報告書 (1) 反応式・計算式など必要なものが記入されている。 (2) 反応式に基づいた計算が正しくされている。 (3) 誤差を考慮している。滴定用キレート試薬として、ドータイト2na(edta2ナトリウム 塩)、その他ドータイト金属指示薬、キレート滴定用補助試薬など、 キレート滴定に必要な試薬類は全部とりそろえているので、ご利 用いただきたい。 nc h2ch2 n ch 2cooh hoocch2 ch2cooh hooc 2 on o n m ch2 ch2




硬度1500mg Lのかた い水がある 水の硬度測定 バイオ科 応用バイオ化学実験 分析化学 2年 036 ブログ 学校のいまを知る 専門学校 東京テクニカルカレッジ




キレート滴定 Kyo Aroma Breath 京都 京北での精油採取から 暮らしの香りへ
ます。水道水のカルシウム硬度測定はキレート滴定(光度検出)で行います。 速やかにNN希釈粉末0.1gを加えて溶解し、0.01mol/L-EDTA溶液で滴定します。 計算式May 27, 10 · EDTA溶液の濃度(mol/l)×EDTA溶液の滴定値(ml)=Ca2とMg2の濃度の総和(mol/l)×試料量(ml) (式) × 3005 = x × 50 = 50x x = (mol/l)入れ滴定を行う。赤紫色から青色に変色したと ころを終点とする。 ⑥ ①~⑤を3回繰り返し、滴定平均値を求める。 ⑦ Ca硬度を計算し求める。 計算式は以下のとおりである。 Ca硬度 B=滴定平均 F=力価(EDTA・2Na 採取量




Images Of 中和滴定 Japaneseclass Jp




メルカリ 分析化学 第2版 参考書 950 中古や未使用のフリマ
計算式は次のようになります。 滴定曲線例 測定結果 滴定条件例 測定回数 試料量 滴定値 全ニッケル濃度 (mL) (mL) (g/L) 1 1 2 1 3 1 170 平均値 : 1124 g/L 統計計算 標準偏差 : 0376 g/L 変動係数 : 033 %となる。 キレート滴定では、この至適 pH を保つために緩衝液が用いられる! XIII13 補助錯化剤 一般にキレート滴定はかなり高い pH で行なうが、このとき金属水酸化物を沈殿させな いように、 EDTA より Kf の小さい錯化剤(=補助錯化剤 )を共存させることがOct 14, 08 · EDTAはCa2と1:1で結合するので、「滴定終点までに加えたEDTAの物質量(mol)= 25mLの水に含まれるCa2の物質量(mol)」ということになります。 EDTA溶液の濃度をC (mol/L)、滴定終点までに加えた体積をa (mL) とすると、その中に含まれるEDTAの物質量はC×a/1000。




Images Of キレート滴定 Japaneseclass Jp



質問箱
水道水の総硬度測定はキレート滴定(光度検出)で行います。 ⑥ EBT指示薬溶液0.5mlを加え、0.01mol/L-EDTA溶液で滴定します。(赤→青) 計算式キレートメトリー(chelatometry),コンプレクソンメトリーともいう.水溶液中で金属イオンとキレート試薬とのキレート生成反応を利用して行う定量分析法で,終点の決定には金属指示薬,pH変化の測定,電位差法,光度法などがある.G Schwarzenbachらにより開発されたEDTA試薬による Ca 2+ ,Mg 2+ を滴定する方法は代表的なものである.キレート滴定法を用いて、未知試料中に含まれる金属イオン(Ca 2+、Mg 2+)の濃度 を調べ、さらに水の硬度についても計算して求める。 また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。 2.原理 金属イオンに配位し、キレート化合物を形成する多座配位子をキレート試薬と呼ぶ。 こ




国際化学オリンピックに挑戦 5 実験 国際化学オリンピックobog会 本 通販 Amazon



Recent Media ファーマプロダクト 福岡校
コニカルビーカーに試料水を採取 (50mlホールピペット) ↓←pH10緩衝溶液(5ml) ↓←Na2S(2ml) ↓←BT指示薬(数滴) 0.01M-EDTA標準溶液 0.01M-EDTA標準溶液で滴定 ビュレットに入れる (3回以上繰り返し) 全硬度の計算方法が広く用いられている。これをキレート滴定という(参考(1)参照)。ここでは水の硬度測定すなわちCa2,Mg2の濃度を キレート滴定によって定量する方法を理解する2)。 < 要 点 > 硬度とは水中のCa2およびMg2の量をCaCO 3(mg CaCO3/L)に換算したものである。硬度には全硬度この反応式は、HClとNaOHが 数字: 数字で反応することを表す。 (中和は指示薬フェノールフタレイン(ピンク→無色)の色の変化から知る) 中和するまでに、01mol/lHCl液をxml要した、とする。 xmlに含まれる、HClの総物質量= これが、NaOHの物質量と等しい。 HClの物質量mol= NaOHの物質量mol x= ml 一般に、溶液間反応にもとづく滴定において、a mol/lの液を滴下し




Dviout 酸と塩 Pdf 無料ダウンロード




エチレンジアミン四酢酸 Edta の性質とキレート滴定について解説 ジグザグ科学 Com
3回の滴定の平均をとる。 ≪Ca2≫ ①試料水を硬度に応じ、25 mL、50 mL、100 mLのいずれかを選択し、ホールピペットを用いてコニカルビーカーにとる。 ②6 mL/L KOH溶液4 mL(pH=12ではマグネシウムは水酸化物Mg(OH)2になり、キレートを生成しない。亜鉛イオン(Zn2)は、キレート滴定によって容易に定量できます。亜鉛のEDTA による滴定が できるpH 領域(pH45~10)は広くかつEDTA に対する安定度定数も大きく、鋭敏に変色する 指示薬も多Jul 19, 12 · No Re原子吸光用Ca標準液を用いた硬度の測定 1721 煮た鯛 (ZWlcd1c 希釈は、大丈夫みたいですね。 私は、原子吸光で分析しているので、滴定法に詳しいわけではありませんが、勉強がてら調べてみると、Mgが存在しないので、終点の識別が、分かりにくいのでは。



年05月 滴定曲線 溶解度などーエクセルを用いて




メルカリ 新 図解食品学実験 参考書 550 中古や未使用のフリマ
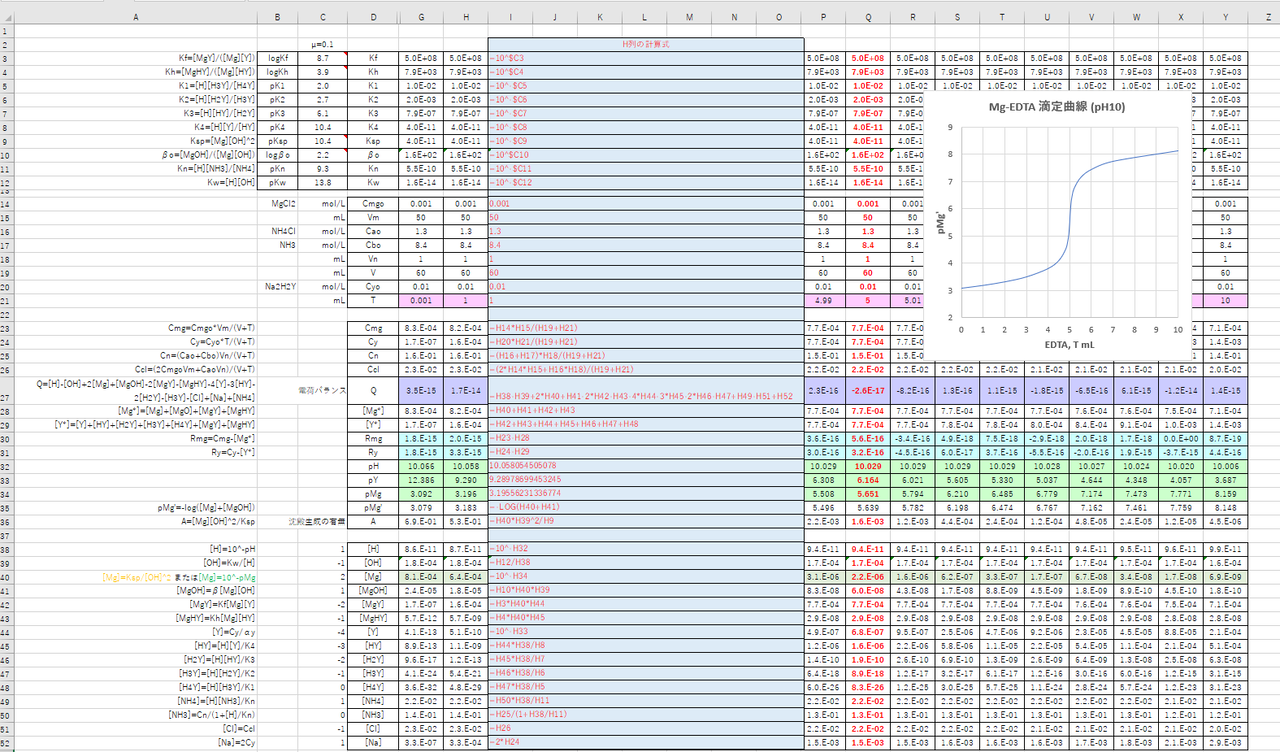
キレート滴定に汎用されるキレート試薬;EDTA(六座配位子) ethylenediaminetetraacetic acid エチレンジアミン四酢酸 >NCH 2CH 2N< CH 2 COOH HOOCH C CH 2 COOH HOOCH C EDTAと金属との反応比は1:1 試薬としては 2Na塩を入手 M Y MY K MY = MY/MY キレート生成定数Jul 11, 11 · キレート滴定法のほか、icp 発光分光分析法も硬度の測定方法の一つです。icp 発光分光分析法は、プラズマ に導き入れた試料中のカルシウム等が発する光を測定して、その濃度を求める方法です。ではプラズマとは何で しょうか。動画は容量分析実験:キレート滴定で実習するMg 2 の定量を例にとって,その操作法を説明している EDTA (エチレンジアミン四酢酸)は,多くの金属イオンと安定なキレート錯体を作る. 指示薬には,金属イオンとキレート錯体を作ることにより,色が変化



逆滴定 例題 計算問題の解き方 原理など 化学のグルメ




ミネラル サプリ キレート 滴定
水の硬度とは、水に溶けているCa 2+ およびMg 2+ の量をCaCO 3 (ppm)に換算したものである。 硬度には、全硬度(Ca 2+ とMg 2+ )、Ca硬度、およびMg硬度がある。 EDTA(エチレンジアミン四酢酸)は、最大6本の腕(6座配位)で2価~4価の金属イオンと、そのイオンの価数に関係なく1:1で結合し



水の硬度 株式会社ユニケミー ユニラボ




水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog




分析実務たん Jis準拠 数式を書くのが面倒なので手書きで




17 号 可搬型滴定装置 Astamuse
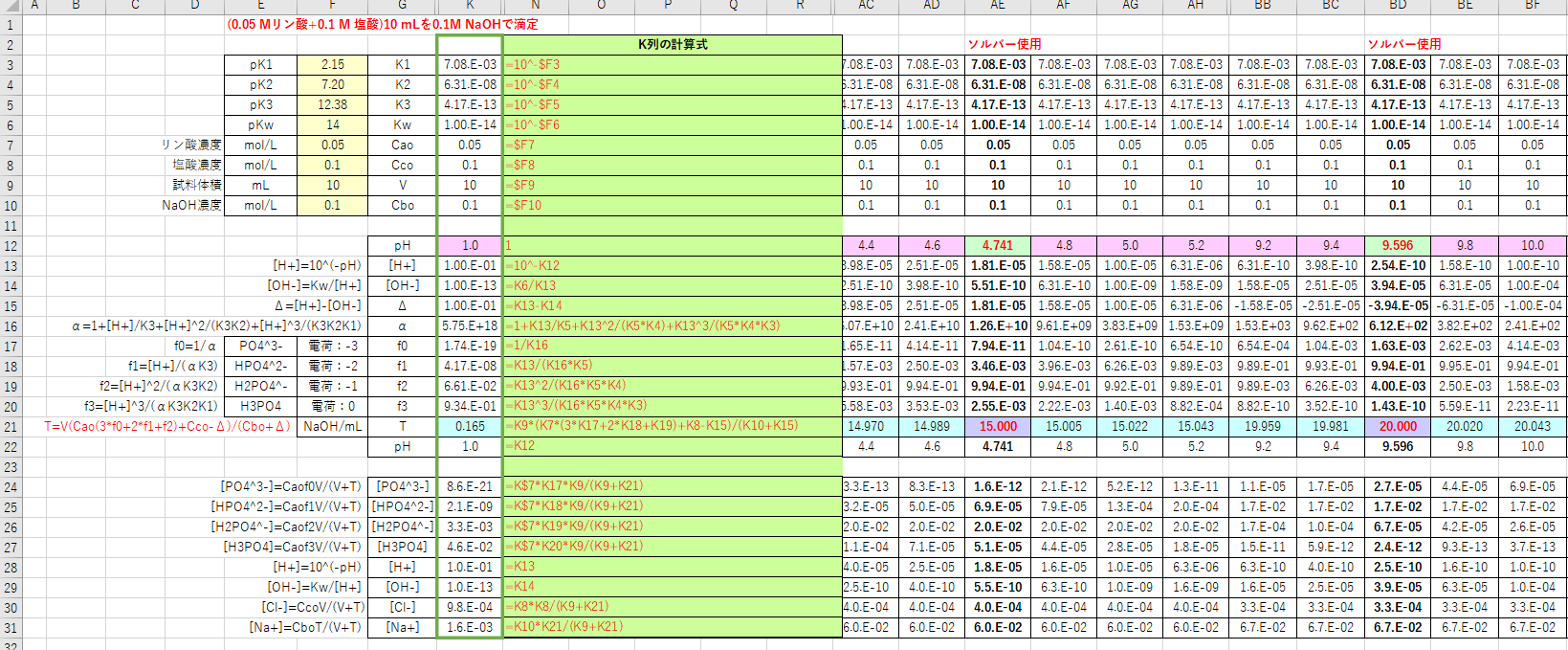



滴定曲線 滴定曲線 溶解度などーエクセルを用いて



Recent Media ファーマ通信予備校 徳島校
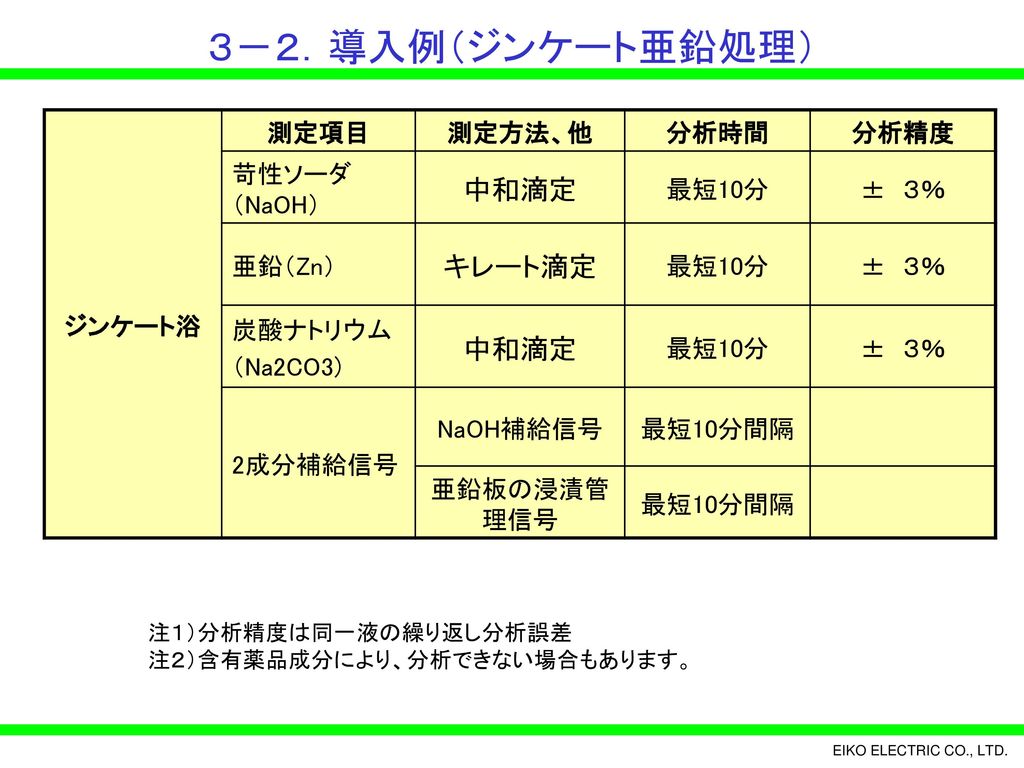



薬液処理浴自動管理装置 めっき管理主任シリーズ のご紹介 Ppt Download
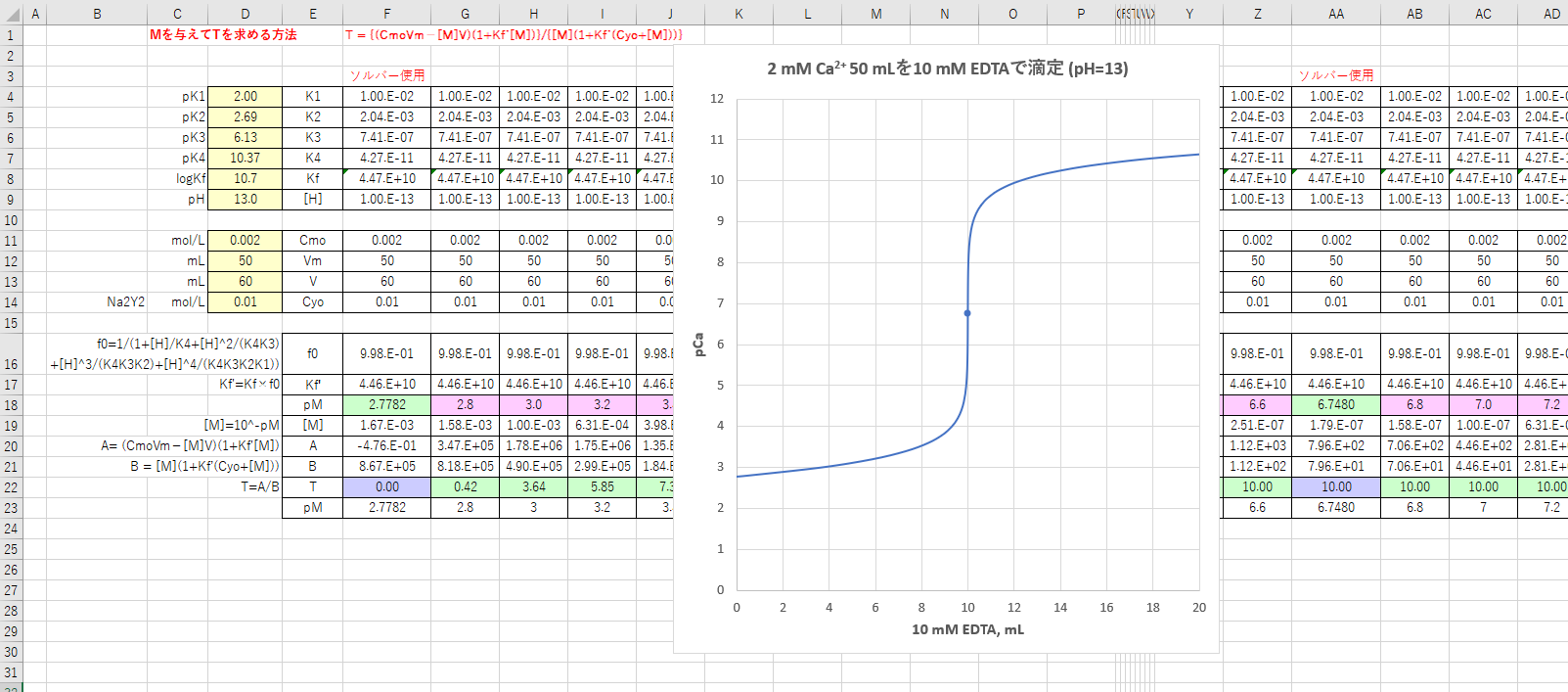



カルシウムのedta滴定 1 滴定曲線 溶解度などーエクセルを用いて




キレート滴定 Kyo Aroma Breath 京都 京北での精油採取から 暮らしの香りへ
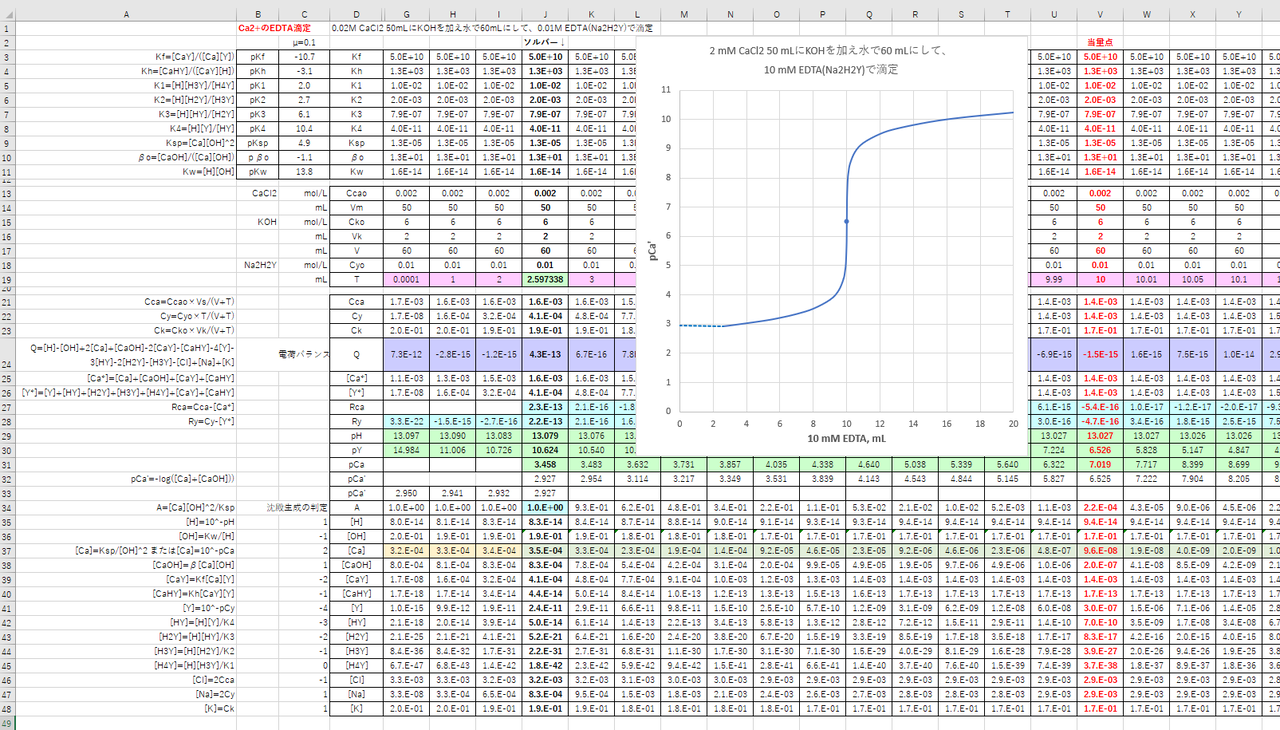



カルシウムのedta滴定 1 滴定曲線 溶解度などーエクセルを用いて




自動滴定装置 Gt 310 自動滴定装置 滴定計 日東精工アナリテック 旧社名 三菱ケミカルアナリテック




17 号 可搬型滴定装置 Astamuse
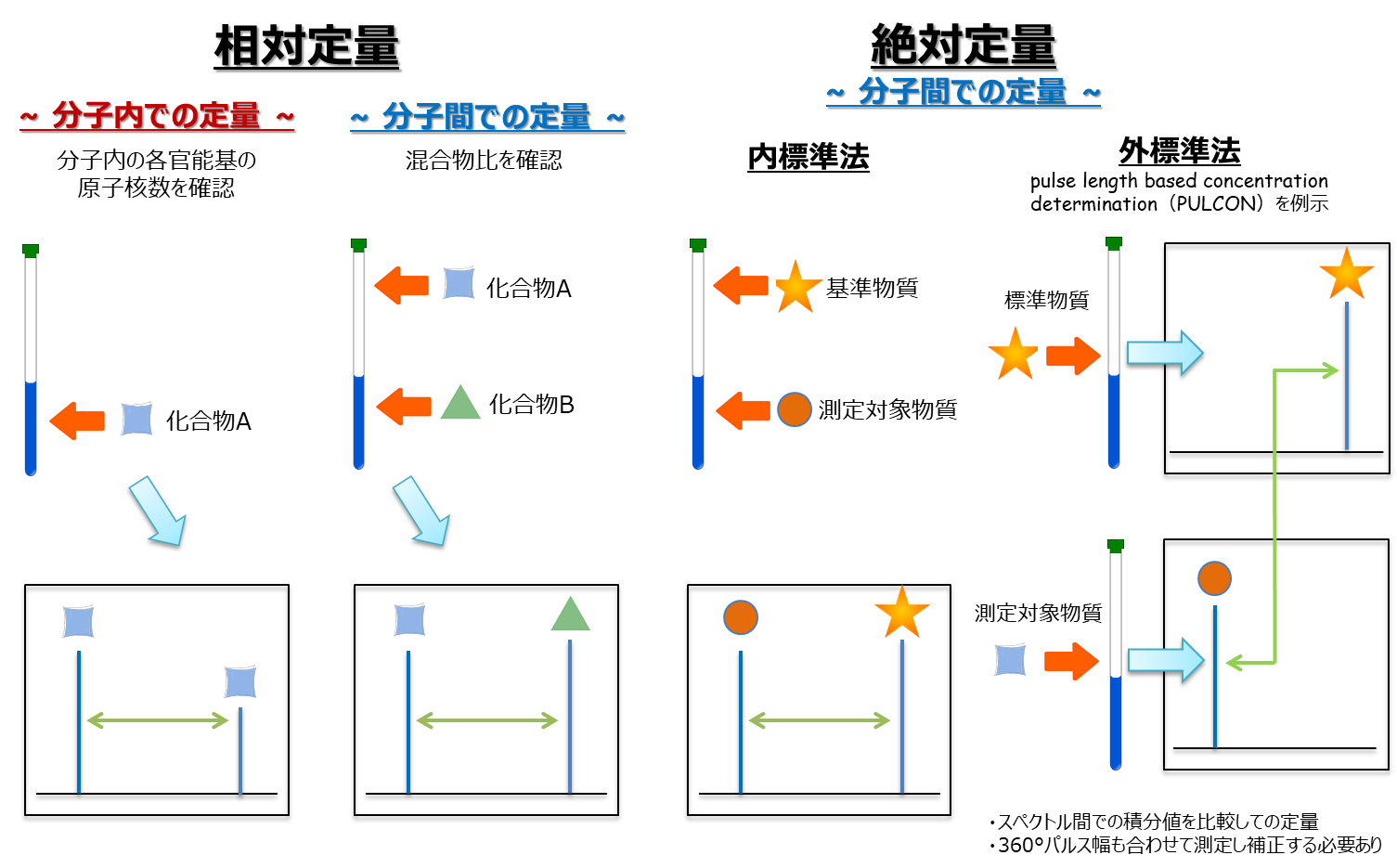



定量nmr Qnmr 核磁気共鳴スペクトル測定 Nmr 分析 試薬 富士フイルム和光純薬




17 号 可搬型滴定装置 Astamuse




水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog



0 件のコメント:
コメントを投稿